
dla pacjentów i lekarzy
Rak przełyku
Spis treści:
1 Wstęp i epidemiologia
2 Etiopatogeneza - czynniki ryzyka
3 Objawy raka przełyku
4 Diagnostyka
4.1.1 Badania endoskopowe
4.1.2 Gastroskopia
4.2 Badania radiologiczne
4.3 Tomografia komputerowa
4.4 Badania USG
5 Klasyfikacja i ocena stopnia zaawansowania raka przełyku
5.1 Klasyfikacja histopatologiczna
5.2 Klasyfikacja TNM raka przełyku
5.3 Stopień zaawansowania (ang. staging) raka przełyku
6 Badania obrazowe w ocenie stopnia zaawansowania
7 Leczenie raka przełyku
7.1 Leczenie chirurgiczne
7.2 Wyłączna radioterapia
7.3 Leczenie pooperacyjne z udziałem radioterapii
7.4 Chemioradioterapia radykalna
7.5 Chemioterapia okołooperacyjna
7.6 Chemioterapia paliatywna
7.7 Schematy chemioterapii
7.8 Leczenie paliatywne
8 Obserwacja po leczeniu i postępowanie w przypadku nawrotów
9 Inne materiały na temat raka przełyku
Wstęp i epidemiologia raka przełyku
Rak o typie histologicznym płaskonabłonkowym jest najczęstszym nowotworem złośliwym tego narządu. Stanowi około 90% wszystkich nowotworów złośliwych przełyku i rozwija się w większości przypadków w proksymalnych 2/3 narządu.
W pozostałych 10% mamy do czynienia z rakiem gruczołowym przełyku. Częstość jego występowania rośnie głównie w dystalnej części przełyku i okolicy wpustu, rozwija się z metaplastycznego nabłonka gruczołowego, którego występowanie ma związek z zarzucaniem treści żołądkowej do przełyku (tzw. przełyk Barretta).
Zachorowalność i umieralność na nowotwory przełyku w Polsce oraz w większości krajów europejskich nie zmienia się istotnie od lat dziewiędziesiątych XX wieku. Krajem o najwyższych wskaźnikach umieralności i zapadalności na ten nowotwór w Europie jest Wielka Brytania - u obu płci stwierdza się wzrost ilości przypadków na przełomie ostatnich dekad.
Nowotwory przełyku znacznie częściej występują u mężczyzn niż u kobiet — w Polsce ponad 4-krotnie częściej. W roku 2017 zarejestrowano 1123 nowych zachorowań u mężczyzn i 280 u kobiet. Liczba zgonów na ten nowotwór w roku 2017 wynosiła odpowiednio: 1189 przypadków u mężczyzn i 312 przypadków u kobiet.
Etiopatogeneza - czynniki ryzyka raka przełyku
Głównymi czynnikami ryzyka zachorowania na raka płaskonabłonkowego przełyku w populacji europejskiej i północnoamerykańskiej są palenie tytoniu (papierosów, fajki wodnej) i spożywanie alkoholu (zwłaszcza wysokoprocentowego) - tym bardziej istotne im zapoczątkowane w młodszym wieku. Uważa się, że łącznie odpowiadają za około 90% zachorowań.
Rak płaskonabłonkowy częściej występuje u osób wcześniej leczonych z powodu nowotworów głowy i szyi lub płuc (radioterapia), po przebytym oparzeniu termicznym (gorące potrawy, gazy) czy chemicznym (kwasy, zasady) przełyku. Poza tym zwraca się uwagę na chroniczne drażnienie substancjami uszkadzającymi nabłonek przełyku - spożywanie ostrych przypraw, nieświeżych warzyw i owoców (nitrozaminy), wdychanie oparów substancji chemicznych, toksyn. Większe narażenie warunkuje współistniejąca achalazja przełyku, zespół Plummer-Vinson, a także genetycznie uwarunkowany zespół tylosis palmaris (charakteryzuje się nadmiernym rogowaceniem skóry stóp i dłoni oraz współistnieniem brodawczaków przełyku).
Niektórzy autorzy zwracają uwagę na rolę wirusa brodawczaka w rozwoju raka przełyku (Papilloma HPV-16). Do czynników ryzyka związanych z dietą należy niedobór pokarmowy witamin A, B2, C i E oraz pierwiastków śladowych, takich jak cynk, magnez, mangan, molibden.
Osoby otyłe mają większe ryzyko rozwinięcia gruczolakoraka przełyku (nawet 4-krotnie w stosunku do pacjentów z prawidłowym BMI), co wiąże się z pewnością z niewłaściwą dietą, poza tym wśród osób z nadwagą statystycznie częściej występuje refluks żołądkowo-przełykowy i przełyk Barreta, które są niezależnymi czynnikami większej chorobowości.
Przełyk Barretta, stan chorobowy polegający na metaplazji dolnej części przełyku (zastąpienia nabłonka wielowarstwowego płaskiego, prawidłowego dla zdrowego przełyku - nabłonkiem walcowatym charakterystycznym dla żołądka) jest istotnym czynnikiem ryzyka gruczolakoraka dolnej części przełyku oraz okolicy wpustu (połączenia przełykowo-żołądkowego).
Przełyk Barretta dotyczy częściej mężczyzn i rozwija się u 10–20% osób cierpiących na przewlekłe zarzucanie treści żołądkowej (GERD) i zapalenie błony śluzowej przełyku. Jest uważany za zmianę przedrakową, ponieważ na jego podłożu częściej statystycznie rozwija się rak typu gruczołowego. U osób z diagnozą refluksu, aby zminimalizować niekorzystny wpływ kwaśnego pH treści żołądkowej, stosuje się leki zmniejszające jej sekrecję - inhibitory pompy protonowej, antagoniści receptora H2, leki prokinetyczne.
Przewlekłe zakażenie błony śluzowej żołądka bakterią Helicobacter pylori nie jest związane z powstawaniem raka gruczołowego przełyku. Prowadzi do zmian zanikowych błony śluzowej żołądka i spadku pH treści żołądkowej na skutek zmniejszania wydzielania zarówno kwasu solnego jak i pepsyny, pośrednio redukując ryzyko rozwinięcia raka przełyku.
Więcej informacji w opracowaniu: Zakażenie błony śluzowej żołądka bakterią Helicobacter pylori
Podstawą rozpoznania raka przełyku jest wynik badania histologicznego wycinków pobranych w czasie endoskopii lub materiału komórkowego uzyskanego z ognisk przerzutowych.
Objawy kliniczne raka przełyku
Rak przełyku szerzy się zarówno wzdłuż ściany (typ ząbkowaty, typ wrzodziejący), jak i wszerz (typ lejkowaty). Typ lejkowaty częściej i szybciej doprowadza do zamknięcia światła przełyku i co za tym idzie do wystąpienia klinicznych objawów: dysfagii, zaburzeń połykania. Dysfagia może manifestować się poprzez: krztuszenie się, kaszel, łzawienie, kichanie, odruchy wymiotne, uczucie zatrzymania pokarmu w przełyku, rozpieranie, odynofagię (ból podczas przełykania).
Objawy dysfagii są najczęściej zgłaszanymi w przypadku raka przełyku. Diagnozę utrudnia fakt późnych zazwyczaj i stopniowo narastających symptomów z manifestacją w poważnym stadium zaawansowania: przełyk jest narządem bardzo rozciągliwym stąd też objawy pojawiają się w momencie, gdy guz obejmuje większość obwodu ściany narządu, a stopień nasilenia dysfagii pośrednio informuje o stadium zaawansowania choroby.
Wyróżniamy cztery stopnie dysfagii:
I stopień – możliwość połykania pokarmów stałych
II stopień – możliwość połykania tyko pokarmów rozdrobnionych
III stopień – możliwość połykania tylko pokarmów płynnych
IV stopień – adagia (całkowity brak możliwości połykania, nawet pokarmów płynnych i śliny)
Utrudnione przechodzenie pokarmu przez zwężony odcinek przełyku powoduje nasilenie perystaltyki (skurczów mięśniówki przełyku), co objawia się występowaniem bólów zamostkowych podczas połykania. Stałe bóle są natomiast wynikiem raczej naciekania przez nowotwór tkanek około przełykowych i nerwów. Przeszkoda w przechodzeniu pokarmów jest przyczyną nudności i zwracania (regurgitatio) pokarmów (niestrawione, bez domieszki treści żołądkowej, o niskim pH), które nie przechodzą do dalszej części przewodu pokarmowego.
Utrata masy ciała jest związana zarówno z problemami w przyjmowaniu pokarmów (objaw wczesny), jak i z wyniszczeniem nowotworowym (kacheksja) w zaawansowanej postaci choroby (objaw późny). Stany te należy różnicować, gdyż wymagają różnego sposobu postępowania leczniczego.
Niekiedy, w przypadku znacznego zaawansowania dochodzi do rozpadu guza nowotworowego, czemu może towarzyszyć okresowe zmniejszenie nasilenia objawów dysfagii.
Naciekanie raka przełyku na nerw krtaniowy wsteczny powoduje wystąpienie chrypki, naciekanie innych nerwów - dolegliwości bólowe, zaburzenia czucia, drętwienia, mrowienia, niewydolność mięśni międzyżebrowych. Naciekanie na drogi oddechowe może spowodować duszności, kaszel z odksztuszaniem krwistej plwociny lub masywny krwotok – w zależności od stopnia ucisku na drogi oddechowe i stopnia ich nacieczenia. Naciekanie nowotworu na aortę może spowodować masywny krwotok, kończący się zgonem chorego.
Wszystkie wymienione objawy są objawami późnymi. Wczesny rak przełyku przebiega bezobjawowo i w związku z tym jest wykrywany sporadycznie np. w trakcie badania endoskopowego wykonywanego z innych przyczyn lub w profilaktycznych badaniach endoskopowych (badania takie prowadzone są w Japonii i Chinach, gdzie zachorowalność na raka przełyku jest duża).
Diagnostyka raka przełyku - ogólne zasady
Objawy wczesne są niespecyficzne, stąd nowotwór, poza przypadkami wykonywania rutynowej kontrolnej gastroskopii (pacjenci obciążeni GERD, H. Pylori, etc.) wykrywany jest zazwyczaj późno.
O rozpoznaniu zaawansowanego raka przełyku decyduje biopsja i ocena histologiczna wycinków pobranych w trakcie badania endoskopowego. Badanie cytologiczne wykonuje się rzadko, głównie w sytuacji braku możliwości uzyskania materiału do badania histologicznego - jest mało specyficzne, obarczone dużym ryzykiem fałszywych rozpoznań. Poza tym w preparacie cytologicznym nie można ocenić ekspresji receptorów HER2, co należeć powinno do rutyny w przypadku nowotworów zlokalizowanych w szczególności w okolicy okołowpustowej.
W Polsce nie prowadzi się programu przesiewowych badań kontrolnych, jednak pacjenci z rozpoznaniem przełyku Barretta wymagają okresowo nadzoru endoskopowego (powtarzana co 3 lata gastroskopia z biopsjami).
Endosonografia (EUS) umożliwia ocenę stopnia zaawansowania miejscowego (głębokość naciekania ściany przełyku) i regionalnego (okołoprzełykowe węzły chłonne) raka przełyku. Dodatkowo podczas badania możliwe jest wykonanie biopsji cienkoigłowej powiększonych węzłów chłonnych (celem oceny zmian przerzutowych), co zwiększa przydatność tej metody.
W specjalistycznych ośrodkach metody endoskopowe wykorzystuje się w leczeniu dysplazji znacznego stopnia oraz najwcześniejszych postaci raka przełyku (Tis i T1a). Poza tym metody endoskopowe znajdują zastosowanie w paliatywnym leczeniu chorych na zaawansowanego, nieoperacyjnego raka przełyku - udrażnianie przełyku poprzez protezowanie, metody ablacyjne.
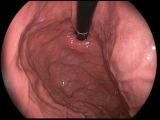
Badania endoskopowe, pobranie wycinków
Dla rozpoznania raka przełyku należy wykonać badanie endoskopowe z pobraniem wycinków guza do badania histopatologicznego. W przypadku martwicy w części guza należy zdjąć szczypczykami tkanki martwe i pobrać wycinki z głębszych, nie martwiczych, tkanek guza. Wycinki z guza pokrytego tkankami martwymi są najczęstszą przyczyną błędów diagnostycznych w ocenie endoskopowej.
W niektórych przypadkach, gdy guz jest umiejscowiony śródściennie, pobranie wycinków może być utrudnione, a także niebezpieczne dla chorego, gdyż może spowodować perforację (przedziurawienie) ściany przełyku. Sytuacja taka doprowadza do zapalenia śródpiersia tylnego (obszar anatomiczny, w którym umiejscowiony jest m.in. przełyk) i wymaga natychmiastowej interwencji chirurgicznej. Nierozpoznane uszkodzenie ściany przełyku może doprowadzić do masywnego zapalenia śródpiersia i zgonu chorego.
Guz umiejscowiony w części środkowej lub górnej przełyku wymaga wykonania bronchofiberoskopii (badanie endoskopowe dróg oddechowych). Badanie to ma na celu ocenę ewentualnego naciekania dróg oddechowych przez guz nowotworowy przełyku, co dyskwalifikuje chorego z leczenia radykalnego. Wskazaniem do wykonania tego badania jest występowanie takich objawów jak kaszel, chrypka, odksztuszanie treścią krwistą czy duszności.
Gastroskopia - przebieg badania, jak się przygotować do badania
jest to badanie wykonywane przy podejrzeniu zmian w obrębie przełyku, żołądka i początkowej części dwunastnicy. Do badania należy być na czczo, przynajmniej kilka godzin (3-6), tak aby nie było zalegania treści pokarmowej w żołądku, którą trudno usunąć za pomocą gastroskopu. Zalecenia dotyczące wziernikowania górnego odcinka przewodu pokarmowego przedstawiono poniżej:
- W dniu badania pacjent musi być na czczo. Dopuszczalne jest picie wody, ale na godzinę przed badaniem powinien zaprzestać picia płynów.
- Osoby z chorobami wymagającymi stałego, regularnego przyjmowania leków (np. nadciśnienie tętnicze, choroby serca, padaczka i inne): w dniu badania należy zażyć poranną dawkę leku popijając niewielką ilością wody.
- Osoby chorujące na cukrzycę powinny skonsultować z lekarzem prowadzącym sposób przygotowania do badania oraz poinformować lekarza wykonującego badanie.
- Osoby przyjmujące leki obniżające krzepliwość krwi (np. acenokumarol, sintrom, ticlid, plavix lub aspirynę i inne) powinny poinformować lekarza wykonującego badanie).
Badanie polega na włożeniu giętkiego endoskopu przez usta do gardła i dalej do przełyku i żołądka. Ze względu na silny odruch wymiotny przy dotknięciu tylnej ściany gardła przed badaniem lekarz znieczula gardło środkiem znieczulającym w aerozolu. Trzeba pamiętać, że odruch połykania zostaje upośledzony na kilka godzin i próba połykania po badaniu endoskopowym płynów lub pokarmów może spowodować zachłyśnięcie dróg oddechowych!
Jeśli pacjent jest bardzo pobudzony i boi się badania, należy zapytać lekarza, czy mógłby podać wcześniej leki uspokajające. W trakcie badania endoskopowego pobiera się szczypczykami wycinki do badania histopatologicznego. Z miejsc, z których pobrano wycinki może dojść do niewielkiego krwawienia, o czym lekarz powinien poinformować. Czasami podanie dużej ilości powietrza w trakcie badania może spowodować wzdęcia i uczucie dyskomfortu w brzuchu oraz odbijania.
Opracowanie na podstawie informacji ze strony: www.endo-gastro.pl, dzięki uprzejmości dr med. Jerzego Wegnera, specjalisty gastroenterologa
Badania radiologiczne
Badanie radiologiczne przełyku z kontrastem (uropolina, baryt) służą uzyskaniu informacji na temat wielkości guza, stopnia zamknięcia przełyku, typu radiologicznego guza oraz, pośrednio, stopnia naciekania okolicznych tkanek. Ta ostatnia ocena polega na pomiarze kąta pomiędzy osią przełyku powyżej i poniżej guza. Jeśli odchylenie osi przełyku jest większe aniżeli 30 stopni, może to świadczyć o naciekaniu okolicznych tkanek i nieoperacyjności guza.
Badanie radiologiczne klatki piersiowej ma na celu ocenę płuc pod kątem istnienia przerzutów raka przełyku, zaburzeń powietrzności płuca (niedodma), które mogą być spowodowane naciekaniem oskrzeli przez guz nowotworowy. Dodatkowe informacje, takie jak istnienie bulli rozedmowych, zmian zapalnych i innych ma wpływ odnośnie kwalifikacji chorego do poszczególnych rodzajów leczenia. Obecnie badanie radiologiczne z kontrastem jest zastępowanie przez tomografię komputerową.
Tomografia komputerowa
Tomografia komputerowa powinna być wykonana w każdym przypadku u chorego z rakiem przełyku, który jest potencjalnym kandydatem do leczenia operacyjnego lub radioterapii. Badanie to pozwala na ocenę zarówno wielkości guza, jak i stopnia zaawansowania miejscowego (powiększone przerzutowo regionalne węzły chłonne, naciekanie innych narządów przez guza nowotworowy). Ograniczeniem tego badania jest częsta rozbieżność pomiędzy oceną przylegania guza do sąsiednich narządów (T3 – guz operacyjny), a ich naciekaniem (T4 – guz nacieka okoliczne tkanki – zmiana nieoperacyjna), co weryfikowane jest dopiero w trakcie zabiegu operacyjnego.
Badania USG
Ultrasonografia jamy brzusznej jest pomocna w ocenie przerzutów do wątroby, powiększenia węzłów chłonnych pod przeponą oraz naciekania przez nowotwór odnóg przepony. Jest wykonywana także w celu oceny węzłów szyjnych i nadobojczykowych.
Ultrasonografia endoskopowa (EUS – endoscopic ultrasonography) pozwala na dokładną ocenę miejscowego stopnia zaawansowania (grubość nacieku w ścianie przełyku, ocena okołoprzełykowych węzłów chłonnych). Ograniczeniem tej metody jest jej dostępność sprzętowa.
Klasyfikacja i ocena stopnia zaawansowania raka przełyku
Rak płaskonabłonkowy przełyku występuje najczęściej w części środkowej (około 50% przypadków) i części dolnej (około 45% przypadków wraz z rakiem typu gruczołowego). Umiejscowienie raka w tych częściach przełyku wymaga leczenia chirurgicznego. W górnej części przełyku rak występuje jedynie u około 2% do 5% chorych. Leczeniem z wybory w tym umiejscowieniu nowotworu jest radioterapia.
Naciek nowotworowy szerzy się zarówno wzdłuż długiej osi przełyku, jak i w kierunku poprzecznym do jego osi, naciekając poszczególne warstwy przełyku, a następnie tkanki otaczające. Brak błony surowiczej pozwala na łatwe naciekanie otaczających tkanek oraz narządów leżących w sąsiedztwie: oskrzela, płuco, aorta i duże naczynia, osierdzie, przeponę. Przerzuty powstają najczęściej drogami limfatycznymi, rzadziej krwionośnymi. Przerzuty w węzłach chłonnych znajdowanych w trakcie operacji występują u ponad 80% chorych.
Klasyfikacja histopatologiczna
Najczęstsza postacią nowotworu złośliwego przełyku jest rak płaskonabłonkowy (carcinoma planoepitheliale). Większość guzów o tym utkaniu histologicznym występuje w środkowej i dolnej części przełyku. Najczęstszą postacią jest typ polipowaty (60% przypadków), następnie typ wrzodziejący (25%) oraz typ płaski (15%). Ten ostatni typ rokuje lepiej niż dwa pozostałe. Rak płaskonabłonkowy rozwija się na podłożu zmian dysplastycznych.
Ze względu na znaczny stopień zaawansowania raka przełyku w momencie zgłaszania się chorych do leczenia, rokowanie jest złe. Ogółem 5 lat przeżywa około 5% - 10%. Rokowanie jest lepsze we wczesnych zmianach ograniczonych do nabłonka (5-letnie przeżycie wynosi około 90%). Zajęcie przez nowotwór błony podśluzowej zmniejsza przeżycie 5-letnie do 50% chorych, zaś w przypadku przerzutów do regionalnych węzłów chłonnych do poniżej 20%.
Poza rakiem płaskonabłonkowym mogą występować inne postacie raka przełyku. Rzadkimi postaciami jest mieszana postać raka płaskonabłonkowego i mięsaka (carcinosarcoma) oraz rak płaskonabłonkowy bazaloidalny. Ten ostatni typ jest bardzo złośliwy, zaś rokowanie jest niekorzystne.
Postacią raka występującego w dolnej części przełyku na bazie tzw. przełyku Barretta (ogniska nabłonka gruczołowego w dolnej części przełyku) jest rak gruczołowy (adenocarcinoma esophagei). Zaawansowany rak gruczołowy rokuje bardzo źle. Wczesna postać powstała na bazie dysfagii (rak in-situ) rokuje korzystnie w przypadku podjęcia leczenia chirurgicznego.
Klasyfikacja TNM raka przełyku (8. edycja UICC)
| T (tumor) - guz pierwotny nowotworu | |
|---|---|
| Tx | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się obecności guza pierwotnego |
| Tis | Rak przedinwazyjny (in-situ) dysplazja wysokiego stopnia |
| T1 | guz nacieka blaszkę właściwą lub mięśniową błony śluzowej lub guz nacieka warstwę podśluzową |
| T1a | guz nacieka blaszkę właściwą lub mięśniową błony śluzowej |
| T1b | guz nacieka warstwę podśluzową |
| T2 | guz nacieka warstwę mięśniową właściwą |
| T3 | guz nacieka przydankę przełyku |
| T4 | guz nacieka sąsiadujące struktury |
| T4a | guz nacieka pleura, pericardium, azygos vein, diaphragm, or peritoneum |
| T4b | guz nacieka aortę, trzon kręgu, tchawicę |
| N (lymph nodes) - stan regionalnych węzłów chłonnych | |
|---|---|
| Nx | nie można ocenić okolicznych węzłów chłonnych |
| N0 | brak przerzutów do regionalnych węzłów chłonnych |
| N1 | 1–2 regionalne węzły chłonne |
| N2 | 3–6 regionalnych węzłów chłonnych |
| N3 | 7 lub więcej regionalnych węzłów chłonnych |
| M (metastases) - przerzuty odległe | |
|---|---|
| M0 | brak przerzutów odległych |
| M1 | obecne przerzuty odległe |
Stopień zaawansowania (ang. staging) raka przełyku (aktualizacja 01/2018)
| Stopień zaawansowania raka płaskonabłonkowego przełyku - ocena kliniczna (cTNM) | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień I | T1 N0,N1 M0 |
| Stopień II | T2 N0,N1 M0 |
| T3 N0 M0 | |
| Stopień III | T1,T2 N2 M0 |
| T3 N1,N2 M0 | |
| Stopień IVA | T4a,T4b N0,N1,N2 M0 |
| każdy T N3 M0 | |
| Stopień IVB | każdy T każdy N M1 |
| Stopień zaawansowania raka płaskonabłonkowego przełyku - ocena patologiczna (pTNM) | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień IA | T1a N0 M0 |
| Stopień IB | T1b N0 M0 |
| Stopień IIA | T2 N0 M0 |
| Stopień IIB | T1 N1 M0 |
| T3 N0 M0 | |
| Stopień IIIA | T1 N2 M0 |
| T2 N1 M0 | |
| Stopień IIIB | T2 N2 M0 |
| T3 N1,N2 M0 | |
| T4a N0,N1 M0 | |
| Stopień IVA | T4a N2 M0 |
| T4b każdy N M0 | |
| każdy T N3 M0 | |
| Stopień IVB | każdy T każdy N M1 |
| Stopień zaawansowania raka gruczołowego przełyku - ocena kliniczna (cTNM) | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień I | T1 N0,N1 M0 |
| Stopień IIA | T1 N1 M0 |
| Stopień IIB | T2 N0 M0 |
| Stopień III | T2 N1 M0 |
| T3,T4a N0,N1 M0 | |
| Stopień IVA | T1-T4a N2 M0 |
| T4b N0,N1,N2 M0 | |
| każdy T N3 M0 | |
| Stopień IVB | każdy T każdy N M1 |
| Stopień zaawansowania raka gruczolowego przełyku - ocena kliniczna (cTNM) | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień IA | T1a N0 M0 |
| Stopień IB | T1b N0 M0 |
| Stopień IIA | T2 N0 M0 |
| Stopień IIB | T1 N1 M0 |
| T3 N0 M0 | |
| Stopień IIIA | T1 N2 M0 |
| T2 N1 M0 | |
| Stopień IIIB | T2 N2 M0 |
| T3 N1,N2 M0 | |
| T4a N0,N1 M0 | |
| Stopień IVA | T4a N2 M0 |
| T4b każdy N M0 | |
| każdy T N3 M0 | |
| Stopień IVB | każdy T każdy N M1 |
Badania obrazowe w ocenie stopnia zaawansowania
W ocenie cechy T (różnicowanie T1–3- głębokość naciekania guza pierwotnego) dokładność EUS sięga 80% oraz charakteryzuje się większą niż tomografia komputerowa skutecznością w ocenie zajęcia regionalnych węzłów chłonnych, poza tym umożliwia wykonanie biopsji cienkoigłowej. Technika badania oraz doświadczenie radiologa odgrywa istotną rolę w skuteczności i przydatności metody. Niestety, nadal jest to metoda mało dostępna oraz, w przypadku znacznego stopnia zaawansowania - bezużyteczna (zmiany nieprzepuszczające endoskopu nie nadają się do badania EUS).
Tomografia komputerowa jest powszechnie dostępna i najczęściej wykonywana w przypadku podejrzenia raka przełyku, ale jej dokładność w ocenie cechy T oraz cechy N nie przekracza 50% - na podstawie TK nie można zróżnicować poszczególnych warstw ściany przełyku ani też precyzyjnie grubości jej naciekania Jej podstawowe znaczenie polega na ocenie nacieku na struktury otoczenia przełyku (T4) i pozwala wysnuć pierwsze podejrzenia nieoperacyjności zmiany podczas planowania leczenia chirurgicznego. Poza tym TK znajduje zastosowanie w poszukiwaniu przerzutów odległych (M1) i węzłowych (N1). Samo badanie tomografu klatki piersiowej nie wystarczy, skany powinny obejmować jamę brzuszną oraz dolną część szyi, z dożylnym i doustnym podaniem środka kontrastowego przed wykonaniem badania.
W ostatnich latach, w związku z coraz szerszym dostępem, rośnie znaczenie pozytonowej tomografii emisyjnej (PET) w połączeniu z TK (ang. PET-CT) w ocenie zaawansowania raka przełyku (zwłaszcza przerzutów odległych - cecha M1) oraz odpowiedzi na leczenie i monitorowania ewentualnych wznów.
Ultrasonografia szyi może mieć zastosowanie przy podejrzeniu przerzutów do węzłów chłonnych szyjnych oraz nadobojczykowych.
Konwencjonalne badanie radiologiczne (RTG) przełyku z doustnym podaniem kontrastu umożliwia ocenę długości nacieku oraz sprawności pasażu - wskazując na typ nacieku (guzowaty, spiralny, lejkowaty) i stopień zwężenia światła, co jest istotne przy planowaniu i ocenie odpowiedzi na radioterapię oraz planowaniu zabezpieczenia żywieniowego chorego (mikroprzetoka do żywienia dojelitowego).
Leczenie raka przełyku
Leczenie raka przełyku jest trudne, obarczone licznymi przeciwnościami i powinno mieć charakter wielodyscyplinarny. Ze względu na znaczne ryzyko intensywnego leczenia, należy się liczyć z poważnymi powikłaniami zarówno ze strony chirurgicznej, anestezjologicznej, jak i tych związanych z podażą cytostatyków i radioterapią - istotny jest indywidualny dobór pacjentów, a leczenie powinno się odbywać wyłącznie w specjalistycznych ośrodkach o dużym doświadczeniu.
Przygotowanie żywieniowe do leczenia chirurgicznego
Chorzy z nowotworami przewodu pokarmowego wykazują w wielu przypadkach cechy niedożywienia, wynikające zarówno z zaawansowania choroby (niedrożność, biegunka, wymioty) jak i zmian metabolicznych, których przyczyną jest stres związany z poważną chorobą.
Stan odżywienia jest jednym z czynników determinujących wybór metody leczenia. Zły stan odżywienia może skutkować niemożnością przeprowadzenia leczenia operacyjnego czy chemioterapii. Wpływa też bezpośrednio na wyniki wdrożonego leczenia, możliwość wystąpienia powikłań i dalsze rokowania.
Istotne jest, aby każdy pacjent był należycie przygotowany do leczenia, a zwłaszcza do zabiegu chirurgicznego. Chorzy w złym stanie odżywienia powinni otrzymać wsparcie żywieniowe przed zabiegiem (preparaty wysokobiałkowe, wysokokaloryczne). Leczenie żywieniowe powinno być nieodłączną częścią właściwego procesu leczniczego.
Więcej informacji w dziale Leczenie żywieniowe.
Leczenie chirurgiczne należy zaoferować wszystkim chorym na resekcyjnego raka przełyku, bez istotnych obciążeń internistycznych, których stan ogólny i wydolność organizmu pozwalają na wykonanie mocno obciążającej operacji.
Natomiast u osób niekwalifikujących się do zabiegu operacyjnego z powodu współistniejących schorzeń lub niewyrażających zgody na leczenie chirurgiczne, a będących w dobrym stanie sprawności należy rozważyć zastosowanie radykalnej chemioradioterapii (CRTH) (leczenie onkologiczne). Chorzy na raka szyjnego lub szyjno-piersiowego odcinka przełyku (< 5 cm od mięśnia pierścienno-gardłowego) powinni otrzymać chemioradioterapię.
Kwalifikacja chorego do leczenia powinna odbywać się w zespole wielodyscyplinarnym chirurgiczno-onkologiczno-radiologicznym.
Z punktu widzenia chirurgicznego, kryteria nieresekcyjności raka przełyku są następujące:
- guzy T4b z naciekaniem dużych naczyń, serca, tchawicy lub innych narządów klatki piersiowej;
- guzy o dużych rozmiarach z przerzutami do węzłów chłonnych w wielu lokalizacjach, w połączeniu z podeszłym wiekiem lub złym stanem ogólnym chorego;
- guzy pierwotnie nieoperacyjne przy braku odpowiedzi (lub progresji) na leczenie przedoperacyjne (neoadjuwantowe);
- rak połączenia przełykowo-żołądkowego z przerzutami do węzłów chłonnych nadobojczykowych;
- chorzy z przerzutami odległymi (M1), w tym chorzy z przerzutami do pozaregionalnych węzłów chłonnych.
Leczenie chirurgiczne
Leczenie chirurgiczne w zależności od stopnia zaawansowania
Nowotwory naciekające warstwę podśluzową (T1b) i głębsze warstwy ściany przełyku powinny być leczone chirurgicznie. W przypadku guzów w stopniu zaawansowania T1a, a więc ograniczonych do błony śluzowej można zastosować metody endoskopowe: resekcję śluzówki (EMR - endoscopic mucosal resection) z ablacją lub leczenie operacyjne (w wyspecjalizowanych ośrodkach).
Guzy T1–T3, nawet ze stwierdzonymi przerzutami do regionalnych węzłów chłonnych są resekcyjne. Decyzje, co do leczenia chirurgicznego chorych z guzami T4 podejmowane są indywidualnie.
Wybór metody leczenia operacyjnego zależy od lokalizacji guza, możliwości odtworzenia ciągłości przewodu pokarmowego (dostępnego narządu), jak i doświadczenia oraz preferencji chirurga. U chorych z dysfagią, w stanie niedożywienia przed zabiegiem, którzy nie są w stanie zaspokoić zapotrzebowania kalorycznego stosując dietę doustną w czasie okresu przedoperacyjnego, należy wykonać endoskopowe rozszerzanie nowotworowego zwężenia przełyku lub założyć jejunostomię odżywczą (zazwyczaj do pierwszej pętli jelita cienkiego) celem podawania diet przemysłowych wysokoenergetycznych.
Zdecydowanie należy unikać wykonywania gastrostomii ze względu na znacznie gorszą jakość życia chorych po takim zabiegu oraz niemożność późniejszego wykorzystania żołądka do odtworzenia ciągłości przewodu pokarmowego podczas ewentualnej operacji radykalnej.
Najczęściej stosowany dostęp operacyjny podczas operacji radykalnej obejmuje: ezofagogastrektomię przezrozworową (bez otwierania klatki piersiowej), laparotomię i prawostronną torakotomię; prawostronną torakotomię i laparotomię z zespoleniem na szyi; lewą torakotomię lub dostęp piersiowo-brzuszny z zespoleniem w klatce piersiowej lub na szyi.
Narządy zastępcze używane celem odtworzenia ciągłości przewodu pokarmowego to (w kolejności preferencji): żołądek, okrężnica, jelito cienkie. Zabieg radykalny w przypadku raka przełyku jest mocno obciążający dla chorego stąd konieczność idealnej kwalifikacji chorego i przygotowania przedoperacyjnego, mając na uwadze wszelkie możliwe skutki uboczne agresywnego leczenia.
W przypadku operacji węzłowych, można wyróżnić następujące zakresy wycięcia węzłów chłonnych: standardowy i rozszerzony. Rozszerzony zakres limfadenektomii przyczynia się do poprawy przeżycia we wszystkich stopniach zaawansowania, z wyjątkiem przypadków najwcześniejszych (ciężka dysplazja, T1aN0M0) i najbardziej zaawansowanych (≥ 7 węzłów chłonnych z przerzutami) oraz dobrze zróżnicowanych guzów pN0M0. Zalecane jest wycięcie minimum 10 węzłów chłonnych u chorych z guzami T1, 20 przy stopniu zaawansowania T2 oraz 30 przy T3–4.
U chorych pierwotnie operowanych (bez przedoperacyjnej chemioradioterapii) pożądane jest wykonanie histopatologicznego badania przynajmniej 15 węzłów chłonnych w celu właściwego określenia stopnia zaawansowania nowotworu.
Chorzy z nowotworem miejscowo nieresekcyjnym lub granicznie resekcyjnym, będący w dobrym stanie sprawności, nie zgłaszający innych przeciwwskazań do wykonania rozległego, obciążającego zabiegu operacyjnego są poddawani przedoperacyjnej CRTH (obserwuje się regresję zmian po leczeniu neoadjuwantowym). W przypadku raka gruczołowego połączenia przełykowo-żoładkowego najczęściej stosuje się przedoperacyjną i pooperacyjną chemioterapię (CTH).
Wyłączna radioterapia
Radioterapia, jako samodzielna metoda (brachyterapia, teleradioterapia) nie jest stosowana celem leczenia radykalnego, znajduje zastosowanie jedynie w leczeniu paliatywnym raka przełyku celem zmniejszenia bólu i objawów niedrożności.
Wskazaniami do teleradioterapii (RTH) paliatywnej są: znaczne zaawansowanie guza uniemożliwiające leczenie chirurgiczne, nieresekcyjna wznowa nowotworu po operacji oraz dysfagia lub ból u chorego w znacznie zaawansowanym stadium choroby.
Kwalifikując chorego do agresywnego leczenia onkologicznego, należy rozważyć ryzyko powikłań wynikających ze współistnienia chorób i obciążeń ogólnych, złego stanu chorego w chwili przyjęcia, obecności (lub zagrożenia wystąpieniem) przetoki do dróg oddechowych lub krwotoku. Przewagą radioterapii nad innymi metodami (endoskopowe rozszerzanie, protezowanie, laseroterapia) jest możliwość uzyskania częściowej regresji guza z poprawą przełykania i zmniejszeniem bólu.
Przy napromienianiu wiązkami zewnętrznymi stosuje się frakcjonowanie: po 3 Gy do 30 Gy lub po 4 Gy do 20 Gy. Sposób frakcjonowania brachyterapii uzależniony jest od stanu ogólnego pacjenta i zasięgu choroby: od 1 frakcji po 10 Gy do 2–3 frakcji po 6–7 Gy w odstępach tygodniowych.
Leczenie pooperacyjne z udziałem radioterapii
Należy rozważać zastosowanie chemioradioterapii pooperacyjnej zawsze u chorych po resekcji nieradykalnej (R1/2). W raku płaskonabłonkowym, po operacji radykalnej (R0) zastosowanie radioterapii nie wpływa na poprawę rokowania.
W raku gruczołowym dolnej części przełyku pooperacyjna chemioradioterapia zwiększa odsetek przeżyć 5-letnich i zmniejsza niepowodzeń miejscowych w porównaniu z chorymi leczo¬nymi wyłącznie operacyjnie.
Alternatywnym postępowaniem jest okołooperacyjna chemioterapia zawierająca cisplatynę i fluorouracyl (FU) lub epirubicynę.
Chemioradioterapia radykalna
Chemioradioterapia pozostaje leczeniem z wyboru raka przełyku w lokalizacji szyjnej. Efekt odległy tego rodzaju terapii jest porównywalny z chirurgicznym zabiegiem radykalnym, a umożliwia uniknięcie niepożądanych skutków mocno okaleczającej operacji. Poza tym jest dobrą alternatywą dla chorych, którzy nie wyrażają zgody na zabieg lub też nie kwalifikują się do niego z powodu współistniejących chorób.
Stosuje się napromienianie wiązkami zewnętrznymi frakcjonowanymi po 2 Gy do dawki 60–66 Gy. W obszarze wysokiej dawki powinny znaleźć się zmienione przerzutowo węzły chłonne. Równocześnie z napromienianiem podawana jest chemioterapia: 2 cykle w odstępie 3 tygodni w kombinacji: cisplatyna (80 mg/m2 i.v. w 1. dniu cyklu) oraz FU (800 mg/m2 i.v. w dniach 1.–4. w ciągłym wlewie 24-godzinnym).
U wybranych chorych z miejscowo zaawansowanym nowotworem można zastosować przedoperacyjną chemioterapię w połączeniu z radioterapią, a następnie ponowną analizę resekcyjności (badania obrazowe). U chorych z guzem granicznie resekcyjnym takie postępowanie stwarza szansę na radykalną operację po leczeniu neoadjuwantowym. Zalecana dawka napromieniania w leczeniu przedoperacyjnym wynosi 50 Gy we frakcjach po 1,8 Gy/dobę.
Nie ustalono konsensusu w sprawie wyboru optymalnego sposobu łączenia metod terapeutycznych u chorych z nowotworem zaawansowanym, pierwotnie resekcyjnym. Dostępnymi opcjami terapeutycznymi są: radykalne leczenie chirurgiczne, samodzielna chemioradioterapia, operacja poprzedzona leczeniem neoadjuwantowym - decyzje, co do wyboru odpowiedniej metody podejmowane są indywidualnie.
Chemioterapia okołooperacyjna
Standardem leczenia gruczolakoraka połączenia przełykowo-żołądkowego w stadium zaawansowania miejscowego jest CTH okołooperacyjna schematem ECF we wlewie ciągłym lub cisplatyną z FU w 5-dniowym wlewie przedłużonym. Taka terapia zwiększa częstość doszczętnych resekcji oraz znacząco wydłuża czas przeżycia i czas do nawrotu.
Chemioterapia paliatywna
Paliatywna chemioterapia w porównaniu z samym tylko leczeniem objawowym u chorych na gruczolakoraka (zwłaszcza lokalizacji okołowpustowej) wydłuża czas życia i poprawia jego jakość. Podczas kwalifikacji do leczenia istotny jest typ histologiczny, stan sprawności, choroby towarzyszące, porównanie przewidywanej tolerancji toksyczności leczenia oraz ocena - w przypadku raka gruczołowego - stanu receptorów HER2.
Optymalnymi kandydatami do paliatywnej chemioterapii są chorzy w dobrym stanie ogólnym. W leczeniu raka gruczołowego stosuje się schematy stosowane w przypadku raka żołądka. Największą skuteczność notuje się w przypadku programów 2 lub 3-lekowych z solami platyny, fluoropirymidyną, antracyklinami lub taksanami. U chorych na raka gruczołowego połączenia przełykowo-żołądkowego z nadekspresją HER2, opcją leczenia pierwszej linii jest trastuzumab (przeciwciało monoklonalne przeciwko receptorom HER-2, które hamuje nadmierną proliferację komórek, wykazujących jego nadekspresję) w skojarzeniu z cisplatyną i FU lub kapecytabiną.
Leczenie paliatywne
Celem leczenia paliatywnego jest likwidacja lub zmniejszenie dolegliwości chorego, który nie kwalifikuje się do leczenia radykalnego z powodu znacznego zaawansowania guza lub obecności przerzutów odległych.
W przypadku raka przełyku najczęstsza dolegliwością związaną z choroba są zaburzenia połykania do całkowitej afagii włącznie. Stan ten powoduje chudnięcie i osłabienie chorego. Jeśli jest to stan spowodowany jedynie zaburzeniami połykania, a nie wyniszczeniem nowotworowym (kacheksja), to udrożnienie przełyku lub przywrócenie możliwości przyjmowania pokarmów inną drogą może doprowadzić do poprawy stanu ogólnego chorego.
W celu udrożnienia światła przełyku zamkniętego przez guz możemy wykonać leczenie za pomocą:
- rozszerzanie mechaniczne
- założenie protezy sztywnej
- założenie protezy samorozprężającej się
- udrożnienie za pomocą lasera
- udrożnienie za pomocą koagulacji bipolarnej
- ostrzykiwanie guza środkami powodującymi jego martwicę
- zastosowanie radioterapii zewnętrznej (teleterapia)
- zastosowanie radioterapii miejscowej (brachyterapia)
Z wymienionych wyżej sposobów leczenia dysfagii najczęściej stosuje się protezy samorozprężające się, laseroterapię, radioterapię zewnętrzna i zewnętrzną.
W przypadku, gdy nie ma technicznych możliwości wykonania powyższych sposobów leczenia, lub stan chorego wymaga szybkiej podaży pokarmów (wyniszczenie), należy rozważyć założenie przetoki do karmienia do jelita cienkiego (zabieg Tawela) lub do żołądka (przetoka Kadera) - przezskórna przetoka dożołądkowa (PEG).
Obserwacja po leczeniu i postępowanie w przypadku nawrotów
Nie istnieje powszechnie przyjęty schemat nadzoru. Zwykle sugeruje się odbywanie wizyt kontrolnych co 3–6 miesięcy przez pierwsze 1–3 lata po leczeniu (potem rzadziej) i postępowanie objawowe - zależnie od symptomatologii.
W większości przypadków rozpoznanie raka przełyku następuje w stadium zaawansowanym, dlatego średni odsetek przeżyć wynosi zaledwie 5-10%.
Profilaktyka opiera się przede wszystkim na modyfikacji stylu życia: leczeniu otyłości, zaprzestanie palenia tytoniu, oraz zdrowej diecie, opartej na świeżych owocach i warzywach, ograniczeniu konserwantów, środków chemicznych. Poza tym zaleca się regularne badania endoskopowe chorych ze zwiększonym ryzykiem zachorowania.
Opracowanie:
dr hab. n. med. Tomasz Jastrzębski, prof. ndzw. GUMed,
Klinika Chirurgii Onkologicznej,
Uniwersyteckie Centrum Kliniczne w Gdańsku.
Bibliografia:
- Gerd Herold i współautorzy; „Medycyna wewnętrzna” Wydawnictwo Lekarskie PZWL Warszawa 2008, wyd.5
- Frączek M.; „Chirurgia nowotworów” Alfa Medica Press Bielsko-Biała 2003, wyd.1
- Krzakowski M.; Jędrzejczak W.; Kowalczyk J. R.; Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych - 2011 r.; wyd. Via Medica, Gdańsk 2012;
- Jeziorski A.; Szawłowski A.W.; Towpik E.; Chirurgia onkologiczna; t. 1 (str. 19, 129), t.2(349, 377, 443, 458- 467), , t. 4 (1007-1033)
- Nowotwory złośliwe : postępowanie wielodyscyplinarne : leczenie systemowe, chirurgia, radioterapia. T. 1 (str. 104-114) pod red. Richard Pazdur [et al. ; tł. Paweł Badurak et al.]
- Cassidy J. „Oxford Handbook of Oncology”- Oxford University Press; July 2010
- „Interna" pod red. prof. dr hab. Franciszka Kokota, tom 1, str. 442–447
- Choroby wewnętrzne” pod red. prof. dr hab. Andrzeja Szczeklika, tom 1, str. 760–763